ความจุของออกซิเจนในสารประกอบคืออะไร?
เพื่อที่จะหาค่าที่เป็นไปได้ความจุของออกซิเจนเราควรศึกษาตำแหน่งของธาตุในตารางธาตุคุณสมบัติหลักของโครงสร้างอะตอมของมัน วิธีการดังกล่าวมีความสะดวกในการศึกษาคำถามที่ว่าความเข้มข้นของออกซิเจนเป็นเรื่องปกติและเป็นลักษณะที่ไม่เป็นไปตามนั้น ในสารประกอบที่พบมากที่สุดความจุปกติคือ II คุณลักษณะนี้ทำให้สามารถระบุจำนวนพันธะของอะตอมอื่นในสูตรไบนารีที่แล้วเสร็จซึ่งเกี่ยวข้องกับออกซิเจน
ความเข้มข้นของออกซิเจนคืออะไร?
ในขั้นเริ่มต้นของการสะสมความรู้เกี่ยวกับสมบัติและโครงสร้างของสารเคมีนักเคมีคิดว่าวาเลน ได้แก่ ความสามารถในการผูกอะตอมจำนวนหนึ่งกับโมเลกุลของสสาร นักวิทยาศาสตร์จำนวนมากหลังจากการค้นพบธาตุพยายามที่จะเข้าใจว่าความจุของออกซิเจนคืออะไร คำตอบได้จากการทดลอง: ออกซิเจนเพิ่มอะตอมของไฮโดรเจนโมโนไวท์ในอะตอมสองอะตอมต่อปฏิกิริยาทางเคมีซึ่งหมายความว่ามีความเป็นไบวาแลนติก การแสดงออกของพันธะเคมีเปลี่ยนไปเนื่องจากความรู้เกี่ยวกับโครงสร้างของสสารที่สะสม ในทฤษฎีของพวกเขา valency, G. Lewis และ V. Kossel เปิดเผยสาระสำคัญของการปฏิสัมพันธ์ทางเคมีจากมุมมองของโครงสร้างอิเล็กทรอนิกส์ นักวิจัยได้อธิบายถึงความสามารถของอะตอมในการสร้างพันธะจำนวนหนึ่งโดยมุ่งมั่นเพื่อให้ได้พลังงานที่มีเสถียรภาพมากที่สุด ถ้าอนุภาคขนาดเล็กที่สุดของสารมีเสถียรภาพมากขึ้น ทฤษฎีและโครงสร้างของลูอิสให้ความสำคัญกับบทบาทของอิเล็กตรอนภายนอกที่มีส่วนร่วมในการสร้างพันธะเคมี

คุณสมบัติของการจัดวางออกซิเจนในตารางธาตุ
เพื่อตรวจสอบความถูกต้องของ yออกซิเจนก็เป็นสิ่งจำเป็นที่จะต้องพิจารณาคุณสมบัติบางอย่างของโครงสร้างอิเล็กทรอนิกส์ของ ออกซิเจนนำกลุ่มของตารางธาตุที่ 16 ชื่อเล็ก ๆ ของครอบครัวขององค์ประกอบคือ "chalcogenes" พวกเขาจะถูกเรียกว่ากลุ่ม VI (A) โดยการจำแนกล้าสมัย ในตารางออกซิเจนตารางอยู่ในเซลล์ภายใต้ข้อ 8 แกนมีอนุภาคมูลฐานเป็นบวก 8 อนุภาคและเป็นอนุภาคมูลฐานที่เป็นกลาง ในพื้นที่ของอะตอมมีสองระดับพลังงานที่เกิดขึ้นเมื่ออิเล็กตรอน 8 ย้าย 6 ซึ่งเป็นภายนอก

ความสัมพันธ์ระหว่างองค์ประกอบของอะตอมและวาเลนชันคืออะไร?
ระดับสุดท้ายของอะตอมของออกซิเจนประกอบด้วย 2unpaired อิเล็กตรอน ธาตุมีค่าน้อยกว่าฟลูออรีนโดยค่าของอิเลคโตรไลท์ (ความสามารถในการดึงดูดคู่อิเล็กตรอนที่เชื่อมโยงกับตัวมันเอง) ในการก่อตัวของสารประกอบที่มีองค์ประกอบอื่น ๆ ออกซิเจนจะดึงดูดความหนาแน่นอิเล็กทรอนิกส์ทั้งหมดที่เกิดขึ้นในโมเลกุล (ยกเว้นอิเล็กตรอนฟลูออรีน) การบรรลุสภาวะที่มั่นคงของเปลือกนอกเป็นไปได้ด้วยการบวกค่าลบสองค่า ซึ่งหมายความว่าออกซิเจนต้องใช้อิเล็กตรอน 2 ตัว ตัวเลือกที่เป็นไปได้ดังนี้: ใช้อิเล็กตรอน (valence II) เลือกอิเล็กตรอน 2 ตัวจากอะตอมอื่น (valence II) อย่าใช้อิเล็กตรอนจากอะตอมอื่น (valence 0) พฤติกรรมทั่วไปของออกซิเจนเป็นลักษณะกรณีที่สอง วิธีนี้คุณสามารถใช้เพื่อหาว่าออกซิเจนเป็นส่วนใหญ่ทั่วไปในสารประกอบทั่วไปของมัน ซึ่งรวมถึงโลหะออกไซด์และอโลหะส่วนใหญ่

valence แสดงออกในสารประกอบอย่างไร?
ออกซิเจนสามารถนำมาใช้ได้โดยตรงโต้ตอบกับองค์ประกอบทางเคมีจำนวนมาก ที่รู้จักกันเป็นสารประกอบของมันกับผู้แทนเกือบทั้งหมดของตารางธาตุ (ยกเว้นก๊าซเฉื่อย: อาร์กอน, ฮีเลียม, นีออน) ในการทำปฏิกิริยากับฮาโลเจนโลหะมีค่าสามารถนำออกซิเจนเข้าสู่ร่างกายได้โดยตรง แต่เป็น Au oxides2O3, F2O, Cl2O7 และอื่น ๆ ที่มีอยู่ (ได้รับทางอ้อม) สำหรับสารประกอบไบนารีในการก่อตัวของออกซิเจนที่มีส่วนร่วมพันธะโควาเลนต์และขั้วเป็นลักษณะ ความหลากหลายในโมเลกุลดังกล่าวขึ้นอยู่กับจำนวนของคู่อิเล็กตรอนที่กำลังเกิดขึ้นใหม่ที่มีการดึงดูดนิวเคลียสของอะตอมต่างๆ อะตอมของออกซิเจนมีส่วนร่วมในการสร้างพันธะโควาเลนต์สองชนิด ตัวอย่างเช่นใน CO ออกไซด์2, P2โอ้5, SO2, SO3, K2O, B2โอ้3, Mo2โอ้5 และในโมเลกุลอื่น ๆ ใน hydronium cation H3O + ออกซิเจนมีค่าความผิดพลาดที่ผิดปกติ III การปรากฏตัวของกลุ่มเปอร์ออกไซด์ -O-O- เป็นผลมาจากลักษณะของไฮโดรเจนเปอร์ออกไซด์ที่ผิดปกติ H2โอ้2. ในสารประกอบนี้ออกซิเจนจะแสดงค่าความเป็นธรรมชาติ II
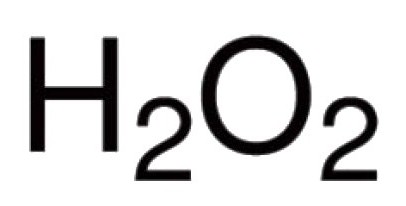
วิธีการตรวจสอบความถูกต้องของธาตุ?
ความคิดเกี่ยวกับความเป็นไปได้ของความสามารถของออกซิเจนให้โครงสร้างลูอิส - สัญญาณทางเคมีของธาตุรอบ ๆ ซึ่งอิเล็กตรอนทำเครื่องหมายชั้นนอก พวกเขามีส่วนร่วมในการสร้างโมเลกุลเป็นส่วนหนึ่งของคู่อิเล็กทรอนิกส์ทั่วไป สูตรลูอิสแสดงให้เห็นถึงความสมดุลของออกซิเจนซึ่งสอดคล้องกับจำนวนอิเล็กตรอนที่ไม่เท่ากัน (2) ผลเดียวกันนี้ได้มาจากการใช้โครงสร้างกราฟิกแบบกราฟิก ในสองเซลล์ของระดับพลังงานภายนอกของออกซิเจนจะมีอิเล็กตรอนที่ไม่เท่ากัน (ระบุด้วยลูกศรในสูตร) ข้อมูลเกี่ยวกับความสามารถของออกซิเจนทำให้สามารถหาค่าสำหรับอะตอมที่อยู่ใกล้เคียงได้จากสูตรสารประกอบไบนารีสำเร็จรูป ด้วยเหตุนี้การคำนวณแบบง่ายๆจะดำเนินการ ประการแรกจำนวนอะตอมของ O จะคูณด้วยเลขยกกำลังของออกซิเจนความจุปกติ ค่าที่ได้ควรจะหารด้วยดัชนีซึ่งระบุไว้ในสูตรข้างสัญลักษณ์ทางเคมีของธาตุอื่นร่วมกับออกซิเจน โดยใช้วิธีง่ายๆเราจะคำนวณความสามารถของคาร์บอนและฟอสฟอรัสในออกไซด์ของพวกเขา
- เราคูณตัวห้อยไปทางขวาใต้เครื่องหมาย O ในก๊าซคาร์บอนไดออกไซด์2 ตามความเหมาะสมโดยทั่วไปของธาตุ: 2 • 2 = 4. จำนวนที่ได้คือหารด้วยดัชนีที่ระบุสำหรับคาร์บอน: 4/1 = 4. ในก๊าซคาร์บอนไดออกไซด์2 คาร์บอนอยู่ในสถานะความจุสูงสุด IV
- ดัชนีที่ด้านล่างขวาของสัญลักษณ์ทางเคมีของออกซิเจนในฟอสฟอรัสออกไซด์ P2โอ้5 คูณด้วยความสมมูลทั่วไปของอะตอม O: 5 • 2 = 10. เราหารหมายเลขนี้โดยดัชนีทางด้านขวาในสูตรด้านล่างจากอะตอมของฟอสฟอรัส: 10/2 = 5. ในฟอสฟอรัสฟอสฟอรัสอยู่ในสถานะความว่องไวสูงขึ้น V.




