โครงสร้างของอะตอม ระดับพลังงานของอะตอม โปรตอนนิวตรอนอิเล็กตรอน
ชื่อ "อะตอม" ถูกแปลจากภาษากรีกว่า "indivisible" ทุกสิ่งรอบตัวเรา - ของแข็งของเหลวและอากาศ - สร้างขึ้นจากอนุภาคเหล่านี้เป็นพันล้าน

การปรากฏตัวของรุ่นเกี่ยวกับอะตอม
เป็นครั้งแรกที่เกี่ยวกับอะตอมมันเป็นที่รู้จักกันในศตวรรษที่ V ก่อนAD เมื่อปราชญ์ชาวกรีก Democritus แนะนำว่าเรื่องประกอบด้วยอนุภาคเล็ก ๆ แต่แล้วไม่มีทางใดที่จะตรวจสอบรุ่นของการมีอยู่ของพวกเขา และแม้ว่าจะไม่มีใครเห็นอนุภาคเหล่านี้ แต่ก็มีการกล่าวถึงแนวคิดดังกล่าวเนื่องจากเพียงเพื่อให้นักวิทยาศาสตร์สามารถอธิบายกระบวนการที่เกิดขึ้นได้ในโลกแห่งความเป็นจริง ดังนั้นพวกเขาจึงเชื่อมั่นในการดำรงอยู่ของอนุภาคขนาดเล็กมานานก่อนเวลาที่พวกเขาสามารถพิสูจน์ความเป็นจริงนี้ได้
เฉพาะในศตวรรษที่ XIX เท่านั้น พวกเขาเริ่มถูกวิเคราะห์ว่าเป็นส่วนประกอบที่เล็กที่สุดขององค์ประกอบทางเคมีที่มีสมบัติเฉพาะของอะตอมซึ่ง ได้แก่ ความสามารถในการผสมกับสารอื่น ๆ ในปริมาณที่กำหนดอย่างเคร่งครัด ในตอนต้นของศตวรรษที่ XX เชื่อว่าอะตอมเป็นอนุภาคที่มีความสำคัญที่สุดของสสารจนกว่าจะมีการพิสูจน์ว่าประกอบด้วยหน่วยที่เล็กกว่า

ธาตุเคมีคืออะไร?
อะตอมของธาตุเคมีเป็นโมเลกุลอาคารอิฐของเรื่อง ปัจจัยที่กำหนดของอนุภาคนี้คือมวลโมเลกุลของอะตอม เฉพาะการค้นพบของกฎหมาย Mendeleev ระยะพิสูจน์ว่าสายพันธุ์ของพวกเขาเป็นตัวแทนของรูปแบบต่างๆของเรื่องเดียว พวกเขามีขนาดเล็กที่พวกเขาไม่สามารถมองเห็นโดยใช้กล้องจุลทรรศน์แบบเดิมเพียงอุปกรณ์อิเล็กทรอนิกส์ที่มีประสิทธิภาพมากที่สุด สำหรับการเปรียบเทียบผมบนมือของมนุษย์เป็นล้านครั้งกว้าง
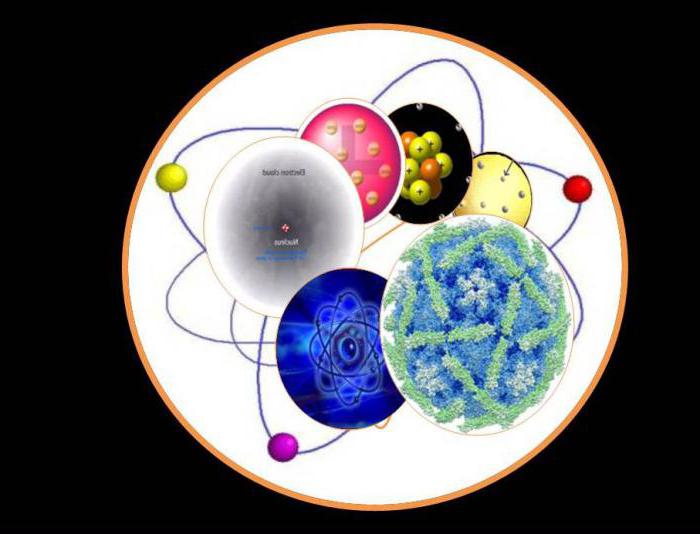
โครงสร้างอิเล็กทรอนิกส์ของอะตอมมีนิวเคลียสประกอบด้วยจากนิวตรอนและโปรตอนรวมทั้งอิเล็กตรอนที่หมุนเวียนอยู่รอบ ๆ ศูนย์กลางในวงโคจรอย่างถาวรเช่นเดียวกับดาวเคราะห์รอบดวงดาว ทุกคนถูกยึดโดยแรงแม่เหล็กไฟฟ้าหนึ่งในสี่หลักในจักรวาล นิวตรอนเป็นอนุภาคที่มีประจุเป็นกลางโปรตอนเป็นบวกและอิเล็กตรอนเป็นลบ หลังถูกดึงดูดให้เกิดโปรตอนที่มีประจุบวกดังนั้นพวกเขาจึงมีแนวโน้มที่จะอยู่ในวงโคจร

โครงสร้างของอะตอม
ในภาคกลางมีการบรรจุหลักส่วนต่ำสุดของอะตอมทั้งหมด แต่การวิจัยแสดงให้เห็นว่าเกือบทั้งหมดมวล (99.9%) ตั้งอยู่ในนั้น อะตอมแต่ละอันประกอบด้วยโปรตอน, นิวตรอน, อิเล็กตรอน จำนวนอิเล็กตรอนหมุนอยู่ในนั้นเท่ากับประจุบวกส่วนกลาง อนุภาคที่มีประจุเดียวกันของนิวเคลียส Z แต่มวลอะตอมที่แตกต่างกัน A และจำนวนนิวตรอนในนิวเคลียส N เรียกว่าไอโซโทป แต่มีแถบ Isobar Z และ N ที่แตกต่างกัน อิเล็กตรอนเป็นอนุภาคต่ำสุดของสสารที่มีประจุไฟฟ้าลบ e = 1.6 · 10-19 ประจุไฟฟ้า ค่าไอออนกำหนดปริมาณของอิเล็กตรอนที่สูญหายหรือเพิ่ม กระบวนการของการเปลี่ยนแปลงของอะตอมที่เป็นกลางเป็นไอออนประจุเรียกว่าไอออไนซ์

รุ่นใหม่ของรูปแบบอะตอม
นักฟิสิกส์ได้ค้นพบวันที่อนุภาคมูลฐานอื่น ๆ อีกมากมาย โครงสร้างอิเล็กทรอนิกส์ของอะตอมมีเวอร์ชันใหม่
เป็นที่เชื่อกันว่าโปรตอนและนิวตรอนไม่ว่าจะเป็นอย่างไรพวกเขาไม่เล็กพวกเขาประกอบด้วยอนุภาคที่เล็กที่สุดซึ่งเรียกว่าควาร์ก เป็นรูปแบบใหม่ในการสร้างอะตอม เนื่องจากก่อนหน้านี้นักวิทยาศาสตร์ได้เก็บหลักฐานการดำรงอยู่ของรูปแบบก่อนหน้านี้ดังนั้นวันนี้จึงพยายามที่จะพิสูจน์การดำรงอยู่ของควาร์ก
RTM - อุปกรณ์แห่งอนาคต
นักวิทยาศาสตร์สมัยใหม่สามารถมองเห็นได้บนจอภาพคอมพิวเตอร์, อนุภาคอะตอมของสสารและเคลื่อนย้ายไปยังพื้นผิวโดยใช้เครื่องมือพิเศษที่เรียกว่า scan microscope tunneling (RTM)
นี่คือ คอมพิวเตอร์ เครื่องมือที่มีปลายที่มีมากค่อยๆเคลื่อนไปใกล้พื้นผิวของวัสดุ เมื่อทิปเคลื่อนไปอิเล็กตรอนจะเคลื่อนที่ผ่านช่องว่างระหว่างปลายกับพื้นผิว แม้ว่าวัสดุจะดูเรียบ แต่ในความเป็นจริงมันไม่สม่ำเสมอในระดับอะตอม คอมพิวเตอร์สร้างแผนที่ของพื้นผิวของสารทำให้ภาพของอนุภาคและนักวิทยาศาสตร์สามารถมองเห็นคุณสมบัติของอะตอมได้
อนุภาคกัมมันตภาพรังสี
ไอออนประจุลบไหลเวียนรอบนิวเคลียสในระยะทางที่พอเพียง โครงสร้างของอะตอมเป็นเช่นที่ทั้งเป็นกลางและไม่มีประจุไฟฟ้าเพราะอนุภาคทั้งหมด (โปรตอน, นิวตรอน, อิเล็กตรอน) มีความสมดุล
อะตอมของกัมมันตรังสีเป็นองค์ประกอบที่สามารถง่ายต่อการแยก ศูนย์ประกอบด้วยโปรตอนและนิวตรอนจำนวนมาก ยกเว้นเป็นเพียงแผนภาพของอะตอมไฮโดรเจนซึ่งมีโปรตอนเพียงตัวเดียว นิวเคลียสล้อมรอบไปด้วยเมฆอิเล็กตรอนซึ่งเป็นจุดดึงดูดของมันทำให้หมุนรอบศูนย์กลาง Protons ขับไล่กันโดยมีค่าใช้จ่ายเดียวกัน
นี้ไม่ได้เป็นปัญหาสำหรับอนุภาคขนาดเล็กที่สุด,ในที่มีอยู่หลายแห่ง แต่บางส่วนของพวกเขาไม่เสถียรโดยเฉพาะอย่างยิ่งสำหรับคนขนาดใหญ่เช่นยูเรเนียมซึ่งมีโปรตอน 92 ตัว บางครั้งศูนย์ของเขาไม่ได้รับภาระดังกล่าว พวกเขาเรียกว่ากัมมันตภาพรังสีเพราะพวกเขาโยนอนุภาคหลายตัวจากนิวเคลียสของพวกมัน หลังจากแกนไม่เสถียรได้กำจัดโปรตอนรูปที่เหลือเป็นลูกสาวคนใหม่ มันสามารถจะมีเสถียรภาพขึ้นอยู่กับจำนวนของโปรตอนในนิวเคลียสใหม่และสามารถแบ่งออกได้ต่อไป กระบวนการนี้ทำงานได้จนกว่าจะมีเคอร์เนลลูกที่มีเสถียรภาพ
สมบัติของอะตอม
คุณสมบัติทางกายภาพและทางเคมีของอะตอมแตกต่างกันไปตามแต่ละองค์ประกอบ พวกเขาจะถูกกำหนดโดยพารามิเตอร์พื้นฐานต่อไปนี้
มวลอะตอม เนื่องจากสถานที่หลักของอนุภาคของโปรตอนและนิวตรอนถูกครอบครองโดยรวมจะคำนวณจากจำนวนที่แสดงในหน่วยมวลอะตอม (amu) สูตร: A = Z + N.
รัศมีอะตอม รัศมีขึ้นอยู่กับตำแหน่งของธาตุในระบบ Mendeleyev พันธะเคมีจำนวนอะตอมที่อยู่ใกล้เคียงและผลควอนตัมโมเลกุล รัศมีของนิวเคลียสมีค่าน้อยกว่ารัศมีของธาตุหนึ่งแสนเท่า โครงสร้างของอะตอมสามารถสูญเสียอิเล็กตรอนและกลายเป็นไอออนบวกหรือเพิ่มอิเล็กตรอนและกลายเป็นไอออนลบ
ในระบบ Mendeleev periodic ใด ๆองค์ประกอบทางเคมีเกิดขึ้น ในตารางขนาดอะตอมจะเพิ่มขึ้นเมื่อเลื่อนจากบนลงล่างและลดลงเมื่อเลื่อนจากซ้ายไปขวา ต่อไปนี้องค์ประกอบที่เล็กที่สุดคือฮีเลียมและธาตุที่ใหญ่ที่สุดคือซีเซียม
ความจุ เปลือกนอกของอะตอมที่เรียกว่าวาเลนซีนและอิเล็กตรอนที่อยู่ในนั้นมีชื่ออย่างถูกต้องว่าเป็นวาเลนซ์อิเล็กตรอน จำนวนของพวกเขากำหนดวิธีอะตอมรวมกับส่วนที่เหลือโดยการเชื่อมโยงทางเคมี วิธีการสร้างอนุภาคขนาดเล็กหลังพยายามที่จะเติมเปลือกหอยวาเลนซ์ด้านนอก
แรงดึงดูดดึงดูดเป็นอำนาจที่ถือดาวเคราะห์ในวงโคจรเพราะมันวัตถุออกมาจากมือตกไปที่พื้น คนสังเกตเห็นแรงโน้มถ่วงมากขึ้น แต่การกระทำด้วยคลื่นแม่เหล็กไฟฟ้ามีประสิทธิภาพมากขึ้นหลายเท่า แรงที่ดึงดูดอนุภาคที่มีประจุในอะตอม (หรือขับไล่) จะมีค่ามากกว่าแรงโน้มถ่วงในตัว แต่ในศูนย์กลางของนิวเคลียสมีพลังมากยิ่งขึ้นที่สามารถจับโปรตอนและนิวตรอนเข้าด้วยกันได้
ปฏิกิริยาในนิวเคลียสสร้างพลังงานทั้งนิวเคลียร์เครื่องปฏิกรณ์ที่อะตอมถูกแยกออก องค์ประกอบที่หนักกว่านั้นอะตอมของมันจะถูกสร้างขึ้นจากอนุภาคมากขึ้น ถ้าเราเพิ่มจำนวนโปรตอนและนิวตรอนในธาตุทั้งหมดเรารู้มวลของมัน ยกตัวอย่างเช่นดาวมฤตยูธาตุที่หนักที่สุดในธรรมชาติมีมวลอะตอมเท่ากับ 235 หรือ 238
แยกอะตอมออกเป็นหลายระดับ
ระดับพลังงานของอะตอมเป็นขนาดพื้นที่รอบนิวเคลียสที่อิเล็กตรอนอยู่ในการเคลื่อนไหว โดยรวมมี 7 orbitals ที่สอดคล้องกับจำนวนงวดในตารางธาตุ ไกลออกไปตำแหน่งของอิเล็กตรอนจากนิวเคลียสสำรองพลังงานที่สำคัญมากขึ้นมันเป็นเจ้าของ ตัวเลขระยะเวลาระบุจำนวน orbitals อะตอมรอบแกนของมัน ตัวอย่างเช่นโพแทสเซียมเป็นองค์ประกอบของช่วงที่ 4 ดังนั้นจึงมี 4 ระดับพลังงานของอะตอม จำนวนของธาตุเคมีที่สอดคล้องกับค่าของมันและจำนวนอิเล็กตรอนรอบนิวเคลียส
อะตอม - แหล่งพลังงาน
อาจเป็นสูตรทางวิทยาศาสตร์ที่มีชื่อเสียงมากที่สุดมันถูกค้นพบโดยนักฟิสิกส์เยอรมัน Einstein เธอระบุว่ามวลคืออะไรมากกว่ารูปแบบของพลังงาน ขึ้นอยู่กับทฤษฎีนี้คุณสามารถเปลี่ยนเรื่องเป็นพลังงานและคำนวณโดยสูตรเท่าใดก็สามารถได้รับ ผลการปฏิบัติครั้งแรกของการเปลี่ยนแปลงนี้คือระเบิดปรมาณูซึ่งได้รับการทดสอบครั้งแรกในทะเลทราย Los Alamos (สหรัฐอเมริกา) และแล้วก็ระเบิดขึ้นทั่วเมืองญี่ปุ่น และแม้ว่าจะเป็นเพียงส่วนที่เจ็ดของระเบิดที่กลายเป็นพลังงานแรงระเบิดของระเบิดปรมาณูก็แย่มาก
เพื่อให้นิวเคลียสปล่อยพลังงานไปได้ต้องถูกทำลาย เมื่อต้องการแยกมันออกไปจำเป็นต้องทำหน้าที่กับนิวตรอนด้านนอก จากนั้นนิวเคลียสจะแตกออกเป็นสองส่วนอื่น ๆ ที่มีน้ำหนักเบาและมั่นใจได้ว่าจะปล่อยพลังงานได้มาก การสลายตัวนำไปสู่การปลดปล่อยนิวตรอนอื่น ๆ และพวกเขายังคงแยกนิวเคลียสอื่น ๆ ออกไป กระบวนการกลายเป็นปฏิกิริยาลูกโซ่ส่งผลให้พลังงานจำนวนมาก

ข้อดีและข้อเสียของการใช้ปฏิกิริยานิวเคลียร์ในยุคของเรา
แรงทำลายล้างซึ่งได้รับการปลดปล่อยให้เป็นอิสระจากการเปลี่ยนแปลงของสสารมนุษยชาติพยายามที่จะเชื่องที่โรงไฟฟ้านิวเคลียร์ ที่นี่ปฏิกิริยานิวเคลียร์ไม่เกิดขึ้นในรูปแบบของการระเบิด แต่เป็นผลตอบแทนจากความร้อนอย่างค่อยเป็นค่อยไป

การผลิตพลังงานนิวเคลียร์มีข้อได้เปรียบและข้อเสีย ตามที่นักวิทยาศาสตร์เพื่อรักษาอารยธรรมของเราอยู่ในระดับสูงจำเป็นต้องใช้แหล่งพลังงานมหาศาลนี้ แต่ก็ควรคำนึงถึงว่าแม้การพัฒนาที่ทันสมัยที่สุดไม่สามารถรับประกันความปลอดภัยที่สมบูรณ์ของโรงไฟฟ้านิวเคลียร์ได้ นอกจากนี้ขยะกัมมันตภาพรังสีที่ได้รับในกระบวนการผลิตพลังงานในกรณีที่จัดเก็บไม่ถูกต้องอาจมีผลต่อลูกหลานของเราเป็นเวลานับหมื่นปี
หลังจากเกิดอุบัติเหตุเชอร์โนบิลมากขึ้นคนพิจารณาการผลิตพลังงานนิวเคลียร์เป็นอันตรายมากสำหรับมนุษยชาติ โรงไฟฟ้าที่มีความปลอดภัยเพียงแห่งเดียวคือดวงอาทิตย์ที่มีพลังงานนิวเคลียร์มีกำลังมหาศาล นักวิทยาศาสตร์กำลังพัฒนาเซลล์แสงอาทิตย์ชนิดต่างๆและบางทีในอนาคตอันใกล้นี้มนุษย์สามารถจัดหาพลังงานนิวเคลียร์ที่ปลอดภัยได้
</ p>
